Повідомлення Державної служби з лікарських засобів та контролю за наркотиками у Хмельницькій області від 23.05.2025 №105-01.1/02/05.23-25
Опубліковано 03.06.2025 о 13:57
ДЕРЖАВНА СЛУЖБА УКРАЇНИ З ЛІКАРСЬКИХ ЗАСОБІВ
ТА КОНТРОЛЮ ЗА НАРКОТИКАМИ
ДЕРЖАВНА СЛУЖБА З ЛІКАРСЬКИХ ЗАСОБІВ ТА КОНТРОЛЮ
ЗА НАРКОТИКАМИ У ХМЕЛЬНИЦЬКІЙ ОБЛАСТІ
Львівське шосе, 10/1, м. Хмельницький, 29016, тел/факс: (0382) 66-01-07
е-mail: dls.km@dls.gov.ua, Код ЄДРПОУ 37098188
|
“23” 05 2025р. №105-01.1/02/05.23-25 |
Керівникам суб’єктів господарювання, лікувально-профілактичних закладів, які займаються реалізацією (торгівлею), зберіганням та медичним застосуванням лікарських засобів (за списком) |
ПОВІДОМЛЕННЯ
1. ФАЛЬСИФІКАЦІЯ
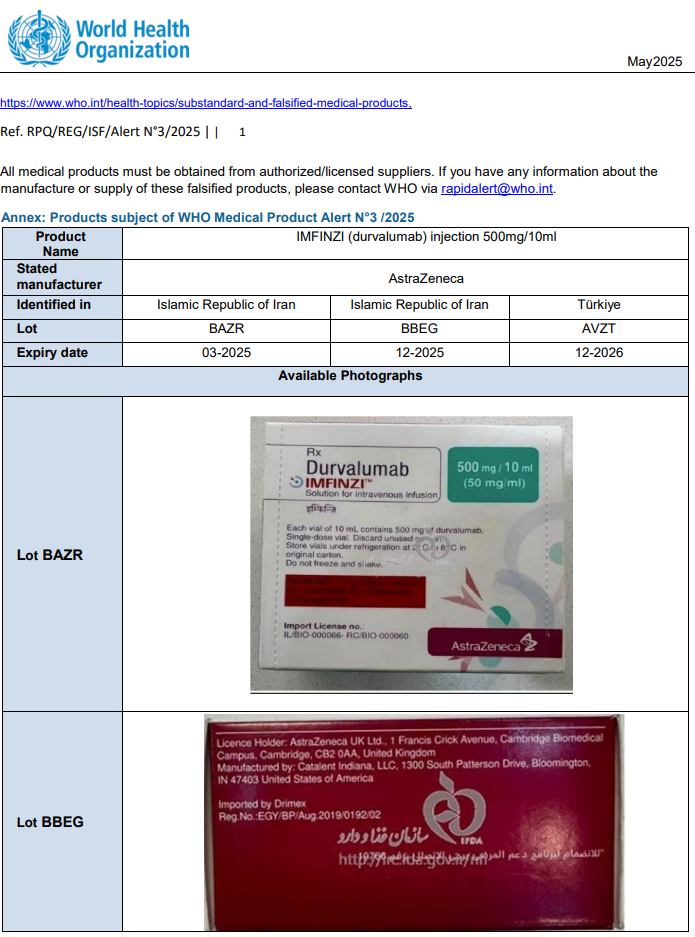
1.1. На підставі міжнародного повідомлення Ref. RPQ/REG/ISF/Alert №3/2025 та інформації від ДУ «Центр громадського здоров’я МОЗ України» (лист від 15.05.2025 №04-12/20/3087/25) щодо виявлення в обігу на території Ірану та Туреччини серій BAZR (термін придатності 03.2025), BBEG (термін придатності 12.2025), AVZT (термін придатності 12.2026) фальсифікованого лікарського засобу, з метою активної протидії поширенню лікарських засобів, шляхи надходження та умови зберігання яких невідомі, визначити якість та безпечність яких неможливо, з огляду на те, що така продукція є небезпечною та може нести потенційну загрозу життю та здоров’ю населення – забороняється реалізація, зберігання та застосування фальсифікованого лікарського засобу:
– IMFINZI (durvalumab) injection 500mg/10ml, серій BAZR, BBEG, AVZT, з маркуванням виробника AstraZeneca (фото додається).
/Розпорядження Держлікслужби №313-001.1/002.0/17-25 від 20.05.2025/.
При виявленні зразків вказаного лікарського засобу вжити заходи щодо вилучення їх з обігу шляхом знищення або повернення постачальнику.
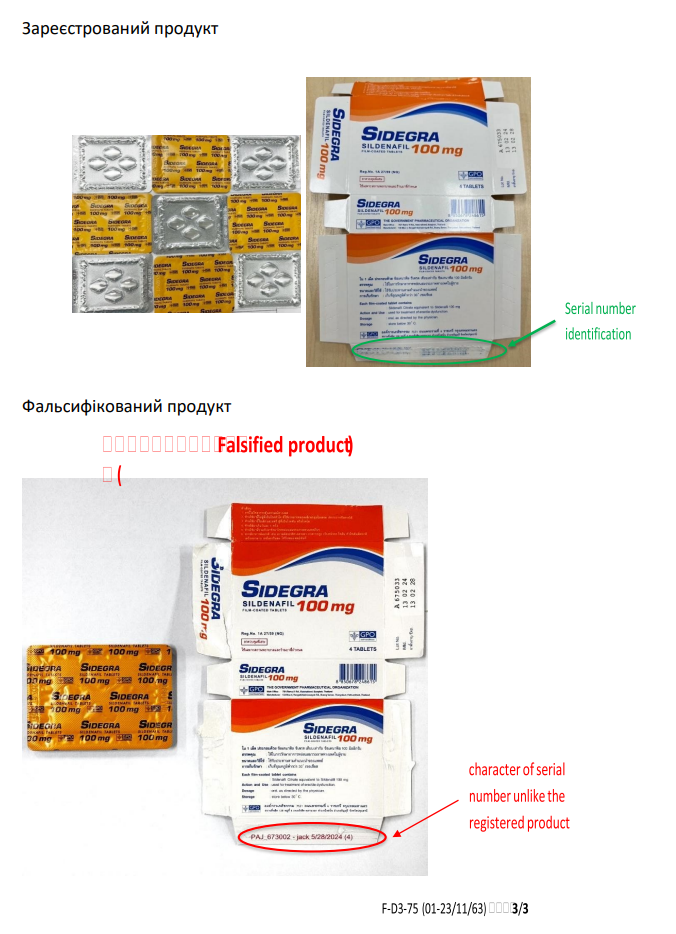
1.2. На підставі надходження міжнародного повідомлення (Rapid Alert) TH/I/2025/017 щодо встановлення факту фальсифікації серії А675033 (термін придатності 13.02.2028) лікарського засобу, з метою активної протидії поширенню фальсифікованих лікарських засобів, що можуть спричинити розвиток хвороби або неналежне лікування, нести потенційну загрозу життю та здоров’ю населення і є небезпечними – забороняється реалізація, зберігання та застосування фальсифікованого лікарського засобу:
– SIDEGRA 100MG, film – coated tablet, 1 box × 4 tablets, серії А675033, країна-виробник Таїланд (фото додається).
/Розпорядження Держлікслужби №319-001.1/002.0/17-25 від 20.05.2025/.
При виявленні зразків вказаного лікарського засобу вжити заходи щодо вилучення їх з обігу шляхом знищення або повернення постачальнику/виробнику.
2. ЗАБОРОНЯЄТЬСЯ
2.1. На підставі надходження звіту Іспанського агенства з лікарських засобів та медичних виробів від 05.05.2025 №РЕ010-4837 про невідповідність вимогам Належної виробничої практики (GMP), інформації від АТ «Київмедпрепарат», Україна (лист від 20.05.2025 №19-01/1446) щодо серій лікарського засобу (виготовлений з використанням активного фармацевтичного інгредієнту ЦЕФЕПІМ ДЛЯ ІН’ЄКЦІЙ, порошок (субстанція) в алюмінієвих ємностях для виробництва стерильних засобів НЕКТАР ЛАЙФСАЕНСЕС ЛІМІТЕД, Індія, реєстраційне посвідчення №UA/18572/01/01) – забороняється реалізація, зберігання та застосування лікарського засобу:
– КВАДРОЦЕФ®, порошок для розчину для ін’єкцій по 1,0г, 1 флакон з порошком у пачці, всіх серій, виробництва АТ «Київмедпрепарат», Україна (реєстраційне посвідчення №UA/11759/01/01).
/Розпорядження Держлікслужби №325-001.1/002.0/17-25 від 22.05.2025/.
2.2. На підставі надходження термінових повідомлень від 20.05.2025 № №338-01.1/03.0/06.10-25, 339-01.1/03.0/06.10-25 Державної служби з лікарських засобів та контролю за наркотиками у м. Києві та негативних сертифікатів якості від 19.05.2025 № №0735, 0736 від уповноваженої лабораторії щодо невідповідності вимогам МКЯ за показником «Маркування» (на вторинній упаковці маркування шрифтом Брайля не відповідає затвердженому тексту маркування) серій 1005711, 1005907 лікарського засобу – забороняється реалізація, зберігання та застосування лікарського засобу:
– ДІКЛОСЕЙФ® ФОРТЕ, емульсійний гель для зовнішнього застосування 2,32%, по 50г у тубі, по 1 тубі у картонній упаковці, серій 1005711, 1005907, виробництва КУСУМ ХЕЛТХКЕР ПВТ. ЛТД., Індія (реєстраційне посвідчення №UA/16445/02/02).
/Розпорядження Держлікслужби №32-001.1/002.0/17-25 від 23.05.2025/.
При виявленні зразків вказаних лікарських засобів вжити заходи щодо вилучення їх з обігу шляхом повернення постачальнику/виробнику або знищення.
3. ТИМЧАСОВО ЗАБОРОНЯЄТЬСЯ
3.1. На підставі надходження термінового повідомлення від 14.05.2025 №106-02.0.3.1/02.0/06.17-25 Державної служби з лікарських засобів та контролю за наркотиками у Полтавській області та негативного висновку щодо якості від 13.05.2025 №76 Лабораторії з контролю якості лікарських засобів та медичної продукції Державної служби з лікарських засобів та контролю за наркотиками у Дніпропетровській області за показником «Маркування» (на вторинній упаковці відсутній шрифт Брайля) серії 111023 лікарського засобу – тимчасово забороняється реалізація та застосування лікарського засобу:
– САЛІЦИЛОВА МАЗЬ, мазь 10% по 25г у тубі ламінатній, по 1 тубі в пачці, серії 111023, виробництва ПрАТ Фармацевтична фабрика «Віола», Україна (реєстраційне посвідчення №UA/6683/01/03).
/Розпорядження Держлікслужби №314-001.1/002.0/17-25 від 20.05.2025/.
При виявленні зразків вказаного лікарського засобу вжити заходи щодо вилучення їх з обігу шляхом поміщення в карантин.
4. ДОЗВІЛ ПОНОВЛЕННЯ ОБІГУ
4.1. На підставі позитивних результатів дослідження серії 0096833 лікарського засобу за всіма показниками МКЯ (сертифікат аналізу від 14.05.2025 №0699) – дозволяється поновлення обігу лікарського засобу:
– ЦЕФАЗОЛІН, порошок для розчину для ін`єкцій по 1,0г, 10 флаконів з порошком у контурній чарунковій упаковці; по 1 контурній чарунковій упаковці у пачці, серії 0096833, виробництва АТ «Київмедпрепарат», Україна (реєстраційне посвідчення №UA/14477/01/02).
/Рішення про поновлення обігу лікзасобу Держлікслужби №311-001.1/002.0/17-25 від 19.05.2025/.
Повідомлення Державної служби з лікарських засобів та контролю за наркотиками у Хмельницькій області №31-01.1/02/05.23-25 від 07.02.2025 (позиція) – відкликається.
4.2. На підставі позитивних результатів додаткового дослідження серії 14241508A лікарського засобу (висновок щодо якості від 14.05.2025 №25/0641/1) – дозволяється поновлення обігу лікарського засобу:
– РАБІМАК, таблетки, вкриті оболонкою, кишковорозчинні по 20мг; по 15 таблеток у блістері; по 2 блістери в картонній упаковці, серії 14241508A, виробництва Маклеодс Фармасьютикалс Лімітед, Індія (реєстраційне посвідчення №UA/3161/01/01).
/Рішення про поновлення обігу лікзасобу Держлікслужби №326-001.1/002.0/17-25 від 22.05.2025/.
Повідомлення Державної служби з лікарських засобів та контролю за наркотиками у Хмельницькій області №9-01.1/02/05.23-25 від 10.01.2025 (позиція) – відкликається.
4.3. На підставі позитивних результатів додаткового дослідження серій EDS23003B1, EDS23004B1 лікарського засобу (висновки щодо якості від 15.05.2025 №498-23, №499-23) – дозволяється поновлення обігу лікарського засобу:
– КОМБІСПАЗМ® ГАСТРОКОМФОРТ, таблетки, вкриті плівковою оболонкою; по 10 таблеток у блістері; по 2 блістери у пачці з картону, серій EDS23003B1, EDS23004B1, виробництва Евертоджен Лайф Саєнсиз Лімітед, Індія (реєстраційне посвідчення №UA/15710/01/01).
/Рішення про поновлення обігу лікзасобу Держлікслужби №333-001.1/002.0/17-25 від 23.05.2025/.
Повідомлення Державної служби з лікарських засобів та контролю за наркотиками у Хмельницькій області №73-02.1/02-30/05.23-24 від 10.05.2024 (позиція) – відкликається.
УВАГА!
1. Держлікслужба вносить уточнення до розпорядження від 16.05.2025 №309-001.1/002.0/17-25 (Повідомлення Державної служби з лікарських засобів та контролю за наркотиками у Хмельницькій області №102-01.1/02/05.23-25 від 19.05.2025), про заборону реалізації (торгівлі), зберігання та застосування лікарських засобів, виробництва НЕКТАР ЛАЙФСАЕНСЕС ЛІМІТЕД, Індія/Nectar Lifesciences, Ltd., India (далі – Розпорядження), а саме:
абзац четвертий та п’ятий пункту 2. Розпорядження читати в наступній редакції:
– ЦЕФИНАК® порошок для оральної суспензії 100мг/5мл 1 флакон з порошком для приготування 50мл суспензії або 1 флакон з порошком для приготування 100 мл суспензії; по 1 флакону з мірним стаканчиком та мірною ложкою в картонній упаковці (№ UA/16758/02/01);
– ЦЕФИНАК®, таблетки, вкриті плівковою оболонкою, по 400 мг по 10 таблеток у блістері; по 1 блістеру в картонній упаковці (№ UA/16758/01/02)»;
пункт 2. Розпорядження доповнити абзацем такого змісту:
– ЦЕФИНАК®, таблетки, вкриті плівковою оболонкою, по 200 мг по 10 таблеток у блістері; по 1 блістеру в картонній упаковці (№ UA/16758/01/01)».
2. Держлікслужба інформує, що Ухвалою про забезпечення позову Київського окружного адміністративного суду від 21.05.2025 №320/24751/25 зупинено дію Розпорядження Державної служби України з лікарських засобів та контролю за наркотиками від 12.05.2025 №303-001.1/002.0/17-25 (Повідомлення Державної служби з лікарських засобів та контролю за наркотиками у Хмельницькій області №99-02.1/02/05.23-25 від 13.05.2025), щодо заборони реалізації, зберігання та застосування всіх серій лікарського засобу АМФОЛІП, суспензія для розчину для інфузій, 5мг/мл, по 2мл, або по 10мл, або по 20мл у скляному флаконі; по 1 флакону в блістері; по 1 блістеру разом з голкою-фільтром у блістері в картонній коробці, виробництва Бхарат Сірамс енд Вакцинс Лімітед, Індія (реєстраційне посвідчення №UA/5704/01/01) до вирішення спору по суті та набрання рішенням суду законної сили.
При наступних поставках вжити заходи щодо запобігання придбанню, застосуванню та реалізації лікарських засобів, наведених в повідомленні.
Результати опрацювання повідомлення надати письмово до Державної служби з лікарських засобів та контролю за наркотиками у Хмельницькій області (29016 м. Хмельницький, Львівське шосе,10/1) до 30.05.2025р. з відповідними документами.
Відповідальність за виконання розпоряджень покладається на керівників суб’єктів господарювання.
Невиконання розпорядження Державної служби тягне за собою відповідальність згідно з чинним законодавством України.
Начальник служби Ігор МІЛІНЧУК
Ганна ТАЛАПЧУК 66-01-07
If you have found a spelling error, please, notify us by selecting that text and pressing Ctrl+Enter.
 Людям із порушенням зору
Людям із порушенням зору  In English
In English 
 Попередня
Попередня