Повідомлення Державної служби з лікарських засобів та контролю за наркотиками у Хмельницькій області від 04.04.2025 №69-01.1/02/05.23-25
Опубліковано 04.04.2025 о 14:59
ДЕРЖАВНА СЛУЖБА УКРАЇНИ З ЛІКАРСЬКИХ ЗАСОБІВ
ТА КОНТРОЛЮ ЗА НАРКОТИКАМИ
ДЕРЖАВНА СЛУЖБА З ЛІКАРСЬКИХ ЗАСОБІВ ТА КОНТРОЛЮ
ЗА НАРКОТИКАМИ У ХМЕЛЬНИЦЬКІЙ ОБЛАСТІ
Львівське шосе, 10/1, м. Хмельницький, 29016, тел/факс: (0382) 66-01-07
е-mail: dls.km@dls.gov.ua, Код ЄДРПОУ 37098188
|
“04” 04 2025р. №69-01.1/02/05.23-25 |
Керівникам суб’єктів господарювання, лікувально-профілактичних закладів, які займаються реалізацією (торгівлею), зберіганням та медичним застосуванням лікарських засобів (за списком) |
ПОВІДОМЛЕННЯ
1. ФАЛЬСИФІКАЦІЯ
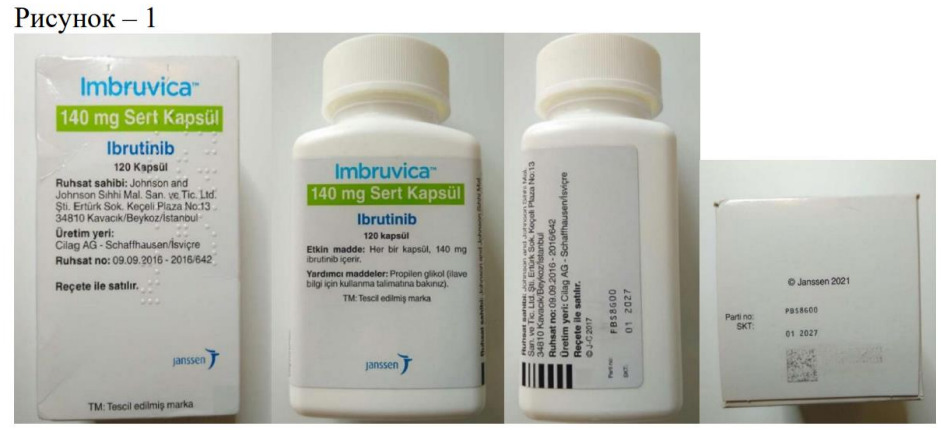
1.1. На підставі повідомлення від 26.03.2025 №R-15/25 ТОВ «Джонсон і Джонсон Україна II» стосовно виявлення в обігу на території України ввезеного з порушенням/підозрілого щодо фальсифікації лікарського засобу серії PBS8G00, з метою активної протидії поширенню лікарських засобів, шляхи надходження та умови зберігання яких невідомі, визначити якість та безпечність яких неможливо, з огляду на те, що така продукція є небезпечною та може нести потенційну загрозу життю та здоров’ю населення – забороняється реалізація, зберігання та застосування фальсифікованого лікарського засобу:
– ІМБРУВІКА/IMBRUVIKA, тверді капсули по 140мг, серії PBS8G00, з маркуванням турецькою мовою та номером серії, що належить турецькому ринку (фото додається).
/Розпорядження Держлікслужби №231-001.1/002.0/17-25 від 28.03.2025/.
При виявленні зразків вказаного лікарського засобу вжити заходи щодо вилучення їх з обігу шляхом знищення або повернення постачальнику.
2. ТИМЧАСОВО ЗАБОРОНЯЄТЬСЯ
2.1. На підставі термінового повідомлення від Державної служби з лікарських засобів та контролю за наркотиками у Київській області від 25.03.2025 №76-01.2/03.0/06.11-25 щодо невідповідності вимогам МКЯ за показником «Маркування» (нечитабельність шрифту Брайля) серії N24347А лікарського засобу – тимчасово забороняється реалізація та застосування лікарського засобу:
– КОМБІНИЛ® ДУО, краплі очні/вушні по 5мл у поліетиленовому флаконі-крапельниці з кришкою-скарифікатором; по 1 флакону-крапельниці в картонній пачці, серії N24347А, виробництва СЕНТІСС ФАРМА ПВТ. ЛТД., Індія (реєстраційне посвідчення №UA/11313/01/01).
/Розпорядження Держлікслужби №230-001.1/002.0/17-25 від 28.03.2025/.
2.2. На підставі надходження термінових повідомлень від 27.03.2025 №№93-01.1/02.0/06.18-25, 94-01.1/02.0/06.18-25 Державної служби з лікарських засобів та контролю за наркотиками у Рівненській області та негативних висновків щодо якості від 27.03.2025 №№36, 33 Лабораторії з контролю якості лікарських засобів та медичної продукції Державної служби з лікарських засобів та контролю за наркотиками у Рівненській області за показником «Маркування» (на вторинній упаковці відсутній шрифт Брайля) серій 060924, 010125 лікарського засобу – тимчасово забороняється реалізація та застосування лікарського засобу:
– САЛІЦИЛОВА МАЗЬ, мазь 5% по 25г у тубі ламінатній, по 1 тубі в пачці, серій 060924, 010125, виробництва ПрАТ Фармацевтична фабрика «Віола», Україна (реєстраційне посвідчення №UA/6683/01/02).
/Розпорядження Держлікслужби №232-001.1/002.0/17-25 від 31.03.2025/.
2.3. На підставі надходження термінового повідомлення від 27.03.2025 №95-01.1/02.0/06.18-25 Державної служби з лікарських засобів та контролю за наркотиками у Рівненській області та негативного висновку щодо якості від 27.03.2025 №34 Лабораторії з контролю якості лікарських засобів та медичної продукції Державної служби з лікарських засобів та контролю за наркотиками у Рівненській області за показником «Маркування» (на вторинній упаковці відсутній шрифт Брайля) серії XD30324 лікарського засобу – тимчасово забороняється реалізація та застосування лікарського засобу:
– ДЕКСАМЕТАЗОН-ДАРНИЦЯ краплі очні, розчин, 1мг/мл по 10мл у флаконі; по 1 флакону у пачці, серії XD30324, виробництва ПрАТ «Фармацевтична фірма «Дарниця», Україна (реєстраційне посвідчення №UA/0992/01/01).
/Розпорядження Держлікслужби №236-001.1/002.0/17-25 від 31.03.2025/.
2.4. На підставі термінового повідомлення від Державної служби з лікарських засобів та контролю за наркотиками у Харківській області №79-01.1/02/06.21-25 та негативного висновку щодо якості від 20.03.2025 №11 Лабораторії з контролю якості лікарських засобів та медичної продукції Державної служби з лікарських засобів та контролю за наркотиками у Дніпропетровській області стосовно невідповідності вимогам МКЯ за показником «Маркування» (на вторинній упаковці відсутнє маркування шрифтом Брайля) серії 50824 лікарського засобу – тимчасово забороняється реалізація та застосування лікарського засобу:
– ОКОМІСТИН®, краплі очні/вушні/для носа, розчин 0,01% по 5мл у флаконі полімерному з крапельницею; по 1 флакону в пачці, серії 50824, виробництва АТ «Фармак», Україна (реєстраційне посвідчення UA/7537/01/01).
/Розпорядження Держлікслужби №242-001.1/002.0/17-25 від 03.04.2025/.
При виявленні зразків вказаних лікарських засобів вжити заходи щодо вилучення їх з обігу шляхом поміщення в карантин.
3. ДОЗВІЛ ПОНОВЛЕННЯ ОБІГУ
3.1. На підставі позитивних результатів додаткового дослідження серії 850724 лікарського засобу за всіма показниками МКЯ до реєстраційного посвідчення №UA/4112/01/02 (сертифікат аналізу від 12.02.2025 №99/10825, висновок щодо якості від 17.03.2025 №25/0311) – дозволяється поновлення обігу лікарського засобу:
– ГЛЮКОЗА, розчин для інфузій 5% по 200мл у контейнері, серії 850724, виробництва ДП «Фарматрейд», Україна (реєстраційне посвідчення №UA/4112/01/02).
/Рішення про поновлення обігу лікзасобу Держлікслужби №240-001.1/002.0/17-25 від 01.04.2025/.
Повідомлення Державної служби з лікарських засобів та контролю за наркотиками у Хмельницькій області №13-01.1/02/05.23-25 від 17.01.2025 (позиція) – відкликається.
3.2. На підставі позитивних результатів дослідження серій N24340А, N24341В, N24342А лікарського засобу (висновки щодо якості від 14.03.2025 №№71-25, 65-25, 66-25) – дозволяється поновлення обігу лікарського засобу:
– ОФТОЛІК, краплі очні по 10мл у пластиковому флаконі-крапельниці; по 1 флакону-крапельниці у картонній пачці, всіх серій, крім серії N23195А, виробництва СЕНТІСС ФАРМА ПВТ. ЛТД., Iндiя (реєстраційне посвідчення №UA/5782/01/01).
/Рішення про поновлення обігу лікзасобу Держлікслужби №241-001.1/002.0/17-25 від 02.04.2025/.
Повідомлення Державної служби з лікарських засобів та контролю за наркотиками у Хмельницькій області №128-01.1/02-30/05.23-23 від 03.11.2023 (позиція) – відкликається частково.
При наступних поставках вжити заходи щодо запобігання придбанню, застосуванню та реалізації лікарських засобів, наведених в повідомленні.
Результати опрацювання повідомлення надати письмово до Державної служби з лікарських засобів та контролю за наркотиками у Хмельницькій області (29016 м. Хмельницький, Львівське шосе,10/1) до 11.04.2025р. з відповідними документами.
Відповідальність за виконання розпоряджень покладається на керівників суб’єктів господарювання.
Невиконання розпорядження Державної служби тягне за собою відповідальність згідно з чинним законодавством України.
Начальник служби Ігор МІЛІНЧУК
Ганна ТАЛАПЧУК 66-01-07
 Людям із порушенням зору
Людям із порушенням зору  In English
In English 
 Попередня
Попередня