Інформаційний лист № 26, 2023 року
Опубліковано 13.04.2023 о 13:08Керівникам суб’єктів господарювання,
які займаються реалізацією, зберіганням
і застосуванням лікарських засобів
Державна служба з лікарських засобів та контролю за наркотиками у Тернопільській області повідомляє:
- Відповідно до Конституції України, статей 15, 22, 55 Закону України “Основи законодавства України про охорону здоров’я”, статей 15, 21 Закону України “Про лікарські засоби”, Положення про Державну службу України з лікарських засобів та контролю за наркотиками, затвердженого постановою Кабінету Міністрів України від 12.08.2015 №647, Порядку встановлення заборони (тимчасової заборони) та поновлення обігу лікарських засобів на території України, затвердженого наказом Міністерства охорони здоров’я України від 22.11.2011 №809, зареєстрованим в Міністерстві юстиції України 30.01.2012 за №126/20439, Порядку контролю якості лікарських засобів під час оптової та роздрібної торгівлі, затвердженого наказом Міністерства охорони здоров’я України від 29.09.2014 №677, зареєстрованим в Міністерстві юстиції України 26.11.2014 за №1515/26292, Правил утилізації та знищення лікарських засобів, затверджених наказом Міністерства охорони здоров’я України від 24.04.2015 №242, зареєстрованим в Міністерстві юстиції України 18.05.2015 за №550/26995, та на підставі інформації Центрального офісу Федеральних земель з охорони здоров’я, лікарських засобів і медичних виробів (Formular 121111_F02_02) щодо відклику з ринку України лікарського засобу МУКОКЕЛЬ D5, розчин для ін`єкцій, по 1 мл в ампулі; по 10 ампул у картонній пачці, серії 21009D, виробництва САНУМ-Кельбек ГмбХ і Ко. КГ, Німеччина (реєстраційне посвідчення № UA/15302/01/01), у зв’язку з невідповідністю за показником МКЯ “Механічні включення” (видимі включення):
ЗАБОРОНЯЮ реалізацію, зберігання та застосування лікарського засобу МУКОКЕЛЬ D5, розчин для ін`єкцій, по 1 мл в ампулі; по 10 ампул у картонній пачці, серії 21009D, виробництва САНУМ-Кельбек ГмбХ і Ко. КГ, Німеччина (реєстраційне посвідчення № UA/15302/01/01).
Суб’єктам господарювання, які здійснюють реалізацію, зберігання та застосування лікарських засобів, невідкладно після одержання даного розпорядження перевірити наявність вказаної серії лікарського засобу, вжити заходи щодо вилучення її з обігу шляхом повернення постачальнику/виробнику або знищення, про що повідомити територіальний орган Держлікслужби. У разі знищення відходів препарату в двотижневий строк направити до територіального органу Держлікслужби копію акта про знищення відходів лікарського засобу.
Контроль за виконанням даного розпорядження здійснюють територіальні органи Держлікслужби на відповідній території.
Невиконання даного розпорядження тягне за собою відповідальність згідно з чинним законодавством України.
Підстава: Лист Держлікслужби №3394-001.1/002.0/17-23 від 12.04.2023.
- Відповідно до Конституції України, статей 15, 22, 55 Закону України “Основи законодавства України про охорону здоров’я”, статей 15, 21 Закону України “Про лікарські засоби”, Положення про Державну службу України з лікарських засобів та контролю за наркотиками, затвердженого постановою Кабінету Міністрів України від 12.08.2015 №647, Порядку встановлення заборони (тимчасової заборони) та поновлення обігу лікарських засобів на території України, затвердженого наказом Міністерства охорони здоров’я України від 22.11.2011 №809, зареєстрованим в Міністерстві юстиції України 30.01.2012 за №126/20439, Порядку контролю якості лікарських засобів під час оптової та роздрібної торгівлі, затвердженого наказом Міністерства охорони здоров’я України від 29.09.2014 №677, зареєстрованим в Міністерстві юстиції України 26.11.2014 за №1515/26292, Правил утилізації та знищення лікарських засобів, затверджених наказом Міністерства охорони здоров’я України від 24.04.2015 №242, зареєстрованим в Міністерстві юстиції України 18.05.2015 за №550/26995, та на підставі інформації Центрального офісу Федеральних земель з охорони здоров’я, лікарських засобів і медичних виробів (Formular 121111_F02_02) щодо відклику з ринку України лікарського засобу НІГЕРСАН D5, розчин для ін’єкцій, по 1 мл в ампулі; по 10 ампул у картонній пачці, серії 30110L, виробництва САНУМ-Кельбек ГмбХ і Ко. КГ, Німеччина (реєстраційне посвідчення № UA/10622/01/01), у зв’язку з невідповідністю за показником МКЯ “Механічні включення” (видимі включення):
ЗАБОРОНЯЮ реалізацію, зберігання та застосування лікарського засобу НІГЕРСАН D5, розчин для ін’єкцій, по 1 мл в ампулі; по 10 ампул у картонній пачці, серії 30110L, виробництва САНУМ-Кельбек ГмбХ і Ко. КГ, Німеччина (реєстраційне посвідчення № UA/10622/01/01).
Суб’єктам господарювання, які здійснюють реалізацію, зберігання та застосування лікарських засобів, невідкладно після одержання даного розпорядження перевірити наявність вказаної серії лікарського засобу, вжити заходи щодо вилучення її з обігу шляхом повернення постачальнику/виробнику або знищення, про що повідомити територіальний орган Держлікслужби. У разі знищення відходів препарату в двотижневий строк направити до територіального органу Держлікслужби копію акта про знищення відходів лікарського засобу.
Контроль за виконанням даного розпорядження здійснюють територіальні органи Держлікслужби на відповідній території.
Невиконання даного розпорядження тягне за собою відповідальність згідно з чинним законодавством України.
Підстава: Лист Держлікслужби №3395-001.1/002.0/17-23 від 12.04.2023.
- У відповідності до Конституції України, статей 15, 22, 55 Закону України “Основи законодавства України про охорону здоров’я”, статей 15, 21 Закону України “Про лікарські засоби”, Положення про Державну службу України з лікарських засобів та контролю за наркотиками, затвердженого постановою Кабінету Міністрів України від 12.08.2015 №647, пункту 4.3. “Порядку встановлення заборони (тимчасової заборони) та поновлення обігу лікарських засобів на території України”, затвердженого наказом МОЗ України від 22.11.2011 за №809 (зі змінами), зареєстрованого Міністерством юстиції України від 30.01.2012 за №126/20439, “Порядку контролю якості лікарських засобів під час оптової та роздрібної торгівлі”, затвердженого наказом МОЗ України від 29.09.2014 №677, зареєстрованого Міністерством юстиції України від 26.11.2014 за №1515/26292, “Правил утилізації та знищення лікарських засобів”, затверджених наказом МОЗ України від 24.04.2015 за №242, зареєстрованого Міністерством юстиції України від 18.05.2015 за №550/26995:
ЗАБОРОНЯЮ реалізацію, зберігання та застосування лікарського засобу Ceftriaxone for Injection, USP, Флакон, порошок, 2 грама., Hospira, серії LG7330.
Суб’єктам господарювання, які здійснюють реалізацію, зберігання та застосування лікарських засобів, невідкладно після одержання даного розпорядження перевірити наявність вищевказаної серії лікарського засобу. При виявленні зразків цього лікарського засобу вжити заходи щодо вилучення його з обігу шляхом знищення або повернення постачальнику (виробнику).
Суб’єкту господарювання, при наявності вказаного лікарського засобу, повідомити територіальний орган Держлікслужби за місцем розташування про вжиті заходи щодо виконання даного розпорядження. У разі знищення відходів лікарського засобу, в двотижневий строк направити до територіального органу Держлікслужби за місцем розташування копію акта про знищення відходів лікарського засобу. При наступних поставках лікарського засобу суб’єкт господарювання повинен вжити заходів щодо запобігання придбанню, реалізації та застосуванню лікарського засобу, наведеного в даному розпорядженні.
Контроль за виконанням даного розпорядження здійснюють територіальні органи Держлікслужби за місцем розташування.
Невиконання даного розпорядження тягне за собою відповідальність згідно чинного законодавства України.
Підстава: Лист Держлікслужби №3410-001.1/002.0/17-23 від 12.04.2023.
- Відповідно до Конституції України, статей 15, 22, 55 Закону України “Основи законодавства України про охорону здоров’я”, статей 15, 17, 21 Закону України “Про лікарські засоби”, Положення про Державну службу України з лікарських засобів та контролю за наркотиками, затвердженого постановою Кабінету Міністрів України від 12.08.2015 №647, Порядку здійснення державного контролю якості лікарських засобів, що ввозяться в Україну, затвердженого постановою Кабінету Міністрів України від 14.09.2005 №902, пункту 3.2.2 Порядку встановлення заборони (тимчасової заборони) та поновлення обігу лікарських засобів на території України, затвердженого наказом Міністерства охорони здоров’я України від 22.11.2011 №809 (зі змінами), зареєстрованого Міністерством юстиції України 30.01.2012 за №126/20439, Порядку контролю якості лікарських засобів під час оптової та роздрібної торгівлі, затвердженого наказом Міністерства охорони здоров’я України від 29.09.2014 №677, зареєстрованого Міністерством юстиції України 26.11.2014 за №1515/26292, Правил утилізації та знищення лікарських засобів, затверджених наказом Міністерства охорони здоров’я України від 24.04.2015 №242, зареєстрованих Міністерством юстиції України 18.05.2015 за №550/26995, на підставі інформації Представництва Елі Ліллі Восток С.А. (Швейцарія) в Україні, що представляє інтереси власника реєстраційного посвідчення Ліллі Франс (лист від 05.04.2023 № 5047) щодо виявлення в обігу на території України фальсифікованої серії 216693Р лікарського засобу «ALIMTA 500 mg» (АЛІМТА), з маркуванням виробника «Lilly», турецькою мовою, яка має ознаки фальсифікації відносно оригінального препарату компанії Ліллі, випущеного для ринку Турції. З метою активної протидії поширенню фальсифікованих лікарських засобів, що можуть спричинити розвиток хвороби або неналежне лікування, нести потенційну загрозу життю та здоров’ю населення і є небезпечним:
ЗАБОРОНЯЮ реалізацію, зберігання та застосування фальсифікованого лікарського засобу «ALIMTA 500 mg» (АЛІМТА), серії 216693Р, з маркуванням виробника «Lilly», турецькою мовою, з наступними ознаками фальсифікації:
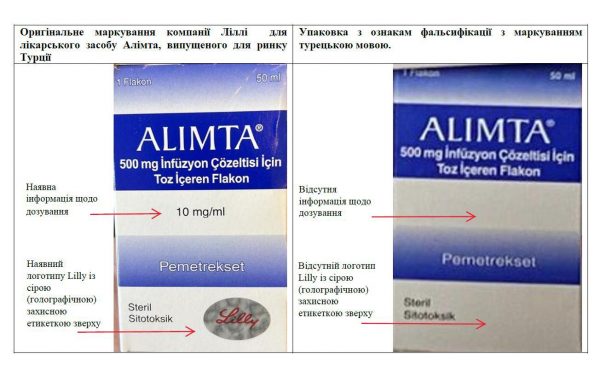
Суб’єктам господарської діяльності, які здійснюють реалізацію, зберігання та застосування лікарських засобів, невідкладно після одержання даного розпорядження перевірити наявність вищезазначеної серії лікарського засобу та у разі виявлення вилучити її з обігу шляхом розміщення в карантин, про що негайно повідомити Держлікслужбу та територіальний орган Держлікслужби на відповідній території.
Контроль за виконанням даного розпорядження здійснюють територіальні органи Держлікслужби на відповідній території.
Невиконання даного розпорядження тягне за собою відповідальність згідно з чинним законодавством України.
Підстава: Лист Держлікслужби №3416-001.1/002.0/17-23 від 12.04.2023.
УВАГА! З текстом розпоряджень та листів Державної служби України з лікарських засобів та контролю за наркотиками Ви можете ознайомитися на офіційному сайті Держлікслужби https://www.dls.gov.ua в розділі «Розпорядження».
Додатково рекомендуємо інформацію щодо виявлених зразків заборонених до реалізації та застосування лікарських засобів подавати за формами повідомлень, розміщених на вебсторінці Державної служби з лікарських засобів та контролю за наркотиками у Тернопільській області у розділі «Повідомлення для СГД»/ «Повідомлення про ЛЗ, що знаходяться на державному контролі».
Завантажити інформаційний лист № 26, 2023 року
If you have found a spelling error, please, notify us by selecting that text and pressing Ctrl+Enter.
 Людям із порушенням зору
Людям із порушенням зору  In English
In English 
 Попередня
Попередня